①我应选择何处作突破口?②再看一下未知条件,能否思考一个具有相同或相似未知条件的熟悉问题?③能否用联想、类比、假设、猜测等方法予以突破?④如果还不能解决眼前问题,那就先解决某个相关问题,再回头解决眼前问题。
2.4回顾阶段
回顾是解题的最后一个环节,它的任务是反思解题过程,对解题过程再认识,检验题解的正确性,扩大题解的成果等。为了使回顾对解题起到调节作用,在解题之后,应让学生学会自己对自己提如下问题:
①我能检验结果的正确性吗?②我为什么要这样做?③我为什么会想到这样做?④我不这样做行不行,还有没有别的 方法?这些方法哪个最好?⑤这个问题改变设问角度,还会变成什么的问题?⑥这个结果与方法还能运用于其它问题?
3.化学解题的优先意识培养的有效途径
3.1构建问题的梯度,突破解题的障碍,开动脑筋寻求解题的最佳方法。
现在的考试不仅仅是书本的重现,而是利用所学的课本知识去完成未学的东西。怎样利用这些信息去解决化学问题,就必须要求我们对解决化学问题有个优先的意识。
根据试题提供的信息作出迅速而直接的判断和猜测。直接法不按照常规的推理步骤和严密的论证而直接得出结论,因此解题思维简化,判断快捷。运用直接法解题,并非胡乱猜测,而是以扎实的知识为基础,是一种知识的结晶与升华。运用直接法应注意以下三点:(1)前题:扎实的双基知识。(2)基础:抓住问题的实质和解决问题的突破口。(3)关键:准确的再现知识
例1矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区常可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学方程式来表示,试写出配平的化学方程式。
[解题思路]由题给的信息可知:反应物有CuSO4·5H2O、FeS2、还有可能有H2O。生成物有中Cu2S,硫和铁的价态运用直接法可确定:绿色溶液—铁以Fe2+进入溶液;溶液无臭味、透明不浑浊、呈强酸性—排除了硫以-2,0,+4等价态进入水溶液的可能,只能以SO42-存在。
[答案]14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
[评注]试题提供信息隐蔽,但只要我们运用直接法,抓住问题的实质,也不难解决。本题应注意元素化合价的升降,Cu的化合价在反应物中为+2价、生成物Cu2S中为+1价,硫元素化合价在FeS2为-1价、生成物Cu2S中为-2价、生成物FeSO4或H2SO4中为+6价,既升又降,在配平时一定要保证化合价升降总数相等,方可完成任务。
3.2让学生在解决化学问题迁移、类推能力中形成化学解题优先意识。
3.2.1组成接近类推形成化学解题优先意识
例2已知乙炔、苯、乙醛的混合蒸汽中含碳的质量分数为84%,求混合物中氧的质量分数。
做法:从分子式[C2H2、C6H6、C2H2]·H2O(改写CH3CHO)可以发现,框内有n(C)=n(H),现令混合物为100g,则m(C)=100×84%=84(g),n(C)=84/12=7(mol),所以,n(H)=7(mol),框内质量为84+7=91(g),故混合物内有“水”9g,其中氧元素质量为9×16/18=8(g),即含氧量为8%。
类推① 已知Fe2(SO4)3和FeSO4的混合物中含硫元素的质量分数为a%,求铁元素的质量分数。
类推② 已知Na2S、Na2SO3、Na2SO4的混合物中含硫元素的质量分数为x%,求氧元素的质量分数。
其中类推题①②不用赘述我们也会从硫和氧、钠和硫的特定关系进行解析,同时学生自己会产生类推③④,并归纳出对含三种元素的混合物中求某种元素质量分数的方法。
3.2.2化学反应类似类推形成化学解题优先意识
例3已知同主族元素的单质及其化合物在性质上有相似之处,试完成下列反应:
①Na2S和CS2溶液反应生成黄色物质。
②P2S5易溶于Na2S溶液。
做法:本题可类推到氧化物的性质:Na2O+CO2=Na2CO3 3Na2O+P2O5 = 2Na3PO4
因氧和硫是同族元素可以迅速迁移得到:
Na2S+CS2= Na2CS3 3Na2S+P2S5 = 2Na3PS4
类推: 卤素互化物如溴化碘IBr、氯化溴BrCl、氯化碘ICl及拟卤化合物氰(CN)2、硫氰(SCN)2、氧氰(OCN)2的性质与卤素单质的性质相似。试完成下列反应:
①Na+IBr → ②NaOH+ICl →
③BrCl+SO2+H2O → ③KSCN+MnO2 →
④(CN)2+H2O → ⑥KSCN+ KHSO4 →
做法:因卤素互化物和拟卤化合物性质与卤素单质相似,因此,只要掌握了Cl2的性质(与Na、NaOH、SO2、H2O的反应),及Cl2的制备和氯化钾的性质,上述反应就能顺利完成。通过反应类 似类推,可提高我们的迁移能力。
3.2.3物质制备对比类推形成化学解题优先意识[来源:Z_xx_k.Com]
例4碳化钙可用于制乙炔,则Al4C3、Fe3C、SiC放入水中情况如何?
做法: 碳化物有离子型如CaC2、MgC2、Al4C3等,共价型如SiC、B4C3等,只有离子型碳化物会与水作用放出气体,其他不与水反应。MgC2+2H2O == Mg(OH)2↓+C2H2↑
Al4C3+12H2O== 4Al(OH)3↓+3CH4↑,而Fe3C是介于典型离子型和共价型之间的过渡情况,与水反应但产物复杂。由于物质之间的联系是多种多样的、错综复杂的,因此我们应从多层次、多方位、多角度去分析问题,产生丰富的类推,进行多方面的迁移,使所学知识体系和能力体系有机结合成一体。
3.3利用数据不足无从下手的计算或混合物组成 判断的题,激发学生形成化学解决问题优先意识.
极值法在是利用数据不足无从下手的计算或混合物组成判断的题,激发学生形成化学解决问题优先意识的有效方法.所谓“极值法”就是对数据不足无从下手的计算或混合物组成判断的题,极端假设恰好为某一成分,或者极端假设 为恰好完全反应,以确定混合体系各成分的名称、质量分数、体积分数的解题方法.
3.3.1用极值法确定物质的成份
在物质组成明确,列方程缺少关系无法解题时,可以根据物质组成进行极端假设得到有关极值,再结平均值原则确定正确答案。
例5.某碱金属单质与其普通氧化物 的混合物共1.40g,与足量水完全反应后生成1.79g碱,此碱金属可能是( )
(A)Na (B)K (C)Rb (D)Li
解析 本题若用常规思路列方程计算,很可能中途卡壳、劳而无功。但是如果将1.4g混合物假设成纯品(碱金属或氧化物),即可很快算出碱金属相对原子质量的取值范围,以确定是哪一种碱金属
假定1.4g物质全是金属单质(设为R) 假定1.40g全是氧化物设为R2O
则:R→ROH △m 则:R2O → 2ROH △m
MR 17 2MR+16 18
1.40 (1.79-1.40)解之MR=61 1.40 (1.79-1.40) 解之MR=24.3
既然1.40g物质是R和R2O的混合物,则R的相对原子质量应介于24.3—61之间。题中已指明R是碱金属,相对原子质量介于24.3—61之间的碱金属只有钾,其相对原子质量为39。答案为B
3.3.2用极值法确定杂质的成份
在混合物杂质成分分析时,可以将主要成分与杂质成分极值化考虑,然后与实际情况比较,那么就迅速判断出杂质的成分。
例6 将13.2克可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH反应,可收集到4 .3升NH3(密度为17克/22.4升),则样品中不可能含有的物质是( )
(A)NH4HCO3、NH4NO3 (B)(NH4)2CO3、NH4NO3
(C)NH4HCO3、NH4Cl (D)NH4Cl、(NH4)2CO3
解析:假设样品为纯(NH4)2SO4,则由(NH4)2SO4→2NH3可知,能产生4.48升NH3,大于4.3升。因此样品中的杂质造成样品NH4+的含量小于纯(NH4)2SO4中NH4+的含量。这就要求选项的两种物质中至少有一种物质的NH4+含量小于(NH4)2SO4中NH4+的含量,都大于是不可能的。可将备选答案化学式变形后进行估算:NH4HCO3→(NH4)2(HCO3)2,NH4NO3→(NH4)2(NO3)2,NH4Cl→(NH4)2Cl2 部分“式量”:(HCO3)=122,(NO3)2=124,Cl2=71,CO3=60,而(NH4)2SO4中,SO4=96,故答案选D。
3.3.3用极值法确定混合气体的平均相对分子质量
两种气体组成的混合气体的平均相对分子质量肯定介于组成气体相对分子质量之间,三种气体组成的混合气体平均相对分子质量肯定介于组成气体相对分子质量最大值和最小值之间,但这个范围太大,依据题目内在关系和极值法可使范围更加准确。
例7 0.03mol Cu完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol 。该混合气体的平均相对分子质量是( )
(A)30 (B)46 (C)50 (D)66
解析:设NO、NO2、N2O4三者的物质的量分别为:x、y、z, x + y + z = 0.05---①式
则依据电子守恒可得:3x+y+2z=0.06---②式,②式减去①式得:2x + z = 0.01
故NO物质的量的极值为0.005 mol ,N2O4物质的量的为极值0.01 mol
若
NO物质的量的为0.005 mol,则NO2为0.045 mol∴ = 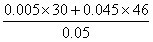 =44.4
=44.4若
N2O4物质的量的为0.01 mol,则NO2为0.04 mol ∴ =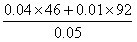 =55.2
=55.2∴该混合气体的平均相对分子质量介于44.4和55.2之间,故答案选B、C
3.3.4用极值法确定可逆反应中反应物、生成物的取值范围
由于可逆反应总是不能完全进行到底的,故在可逆反应中,分析反应物、生成物的量的取值范围时利用极值法能达 到目标明确,方法简便,范围正确。
例8 容积不变的反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达平衡时保持气体总物质的量为12mol,现向反应容器中通入6.5molA、xmolB和2molC,欲使起始反应向逆反应方向移动,x的取值范围为
解析:依题意:6.5+x+2<12,x<3.5(逆向为物质的量增加的反应,故6.5+x+2小于12)
一般同学都能顺利解出这步,但对x的另一范围部分同学就存在困难,若假设C(极值)能完全转化,则x的极值马上可得。设2molC完全转化为A、B,则(6.5+1)+(x+2)>12,x>2.5(因C实际不能完全转化,故(6.5+1)+(x+2)大于12 。实际上C转化一部分满足12mol) 故答案为2.5
3.3.5用极值法确定反应时的过量情况
当反应物以混合物的总质量或总物质的量已知时,可以利用极值假设全部是某一反应物,然后假设全部是另一反应物,再假设两者则好完全反应,从而得到解题的线索。
例9 18.4g NaOH 和NaHCO3固体混合物,在密闭容器中加热到250℃,经过充分反应后排除气体,冷却,称得剩余固体质量为16.6g,试计算原混合物中NaOH的质量分数。
解析:这是在 密闭容器中进行反应,可能的反应有:
NaOH+ NaHCO3 = Na2CO3+H2O ---① 2NaHCO3 = Na2CO3+ CO2↑+ H2O---②
40 84 106 168 106
究竟按何种情况反应,必须判断出NaOH与NaHCO3在反应①中何者过量,然后才能进行计算,借助极值法,能使判断方便直观。[来源:学&科&网Z&X&X&K]
设18.4g 固体全为NaOH,则受热不减少,剩余固体18.4g。
设18.4g 固体全为NaHCO3,则按②反应,剩余固体(18.4g÷84 g/mol)×106 g/mol=11.6g
设18.4g 固体恰好按①完全反应,则剩余固体÷(40+84)g/mol×106 g/mol =15.7g
∵现剩余固体16.6g,介于15.7g和18.4g之间,∴应为NaOH过量,以后的计算就比较方便了。
NaOH+ NaHCO3 = Na2CO3+H2O △m
40 84 106 18
x= 8.4g 18.4g-16.6 g
m(NaOH)= 18.4g-8.4 g = 10 g
m(NaOH)% = 10 g/18.4g ×100% = 54.3%
3.3.6用极值法确定反应巧解计算题
例10 某混合物含有KCl、NaCl和Na2CO3,经分析含钠31.5%,含氯27.08%(以上均为质量分数),则混合物中Na2CO3的质量分数为( )
(A)25% (B)50% (C)80% (D)无法确定
解析: 若混合物质量为100g,则可求出n (Cl-)= 0.763mol ,①假设这0.763mol的Cl-全部来自于KCl(即混合物为KCl和Na2CO3)则m(KCl)=56.84g,②假设这0.763mol的Cl-全部来自于NaCl(即混合物为NaCl和Na2CO3)则m(NaCl)=44.63g,因Cl-来自于NaCl、KCl两种物质,由平均值原理知(1-56.84%)<m(Na2CO3) %<(1-44.63%)故答案选B[来源:学.科.网]
3.3.7用极值法确定化学反应方程式
例7 已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了A测定的组成,进行如下实验:(1)当Cl2和NO2混合气体以不同比例混合时,测得其平均相对分子质量为51及61,则Cl2在上述 混合气体中的体积分数分别为 和 ;
(2)取上述不同比例的混合气体各5 L ,分别在一定条件下充分反应,气体体积仍均为4L,则Cl2与NO2反应的化学方程式为:
解析:此题第一问依据混合气体平均相对分子质量的定义法马上可求得Cl2在上述混合气体中的体积分数分别为1/5和 3/5。在第二问中,由于总体积为5 L,故第一种条件下气体组成为:Cl2:1 L、NO2 4L ;第二种条件下气体组成为:Cl2:3L、NO2 2L。
由题意可知反应方程式只有一个,可不同条件下体积变化值相同,说明参加反应的量相同,故在两种条件下,肯定都存在一种反应物刚好完全反应,另一种反应过量的情况,所以两种条件下同一种成分的极小值刚好完全反应,即1 L Cl2和2L NO2恰好完全反应,故化学为:Cl2+2NO2=2NO2Cl(体积之比等于计量系数之比)
4结语
心理学研究表明,意识的形成过程是有阶段性的,即有一个由初级阶段到熟练掌握的阶段。学生化学解题优先意识的培养也要遵循这个规律。因此,教师在日常教学中一定要重视激发学生化学解题优先意识的培养。马卡连柯曾指出:"一般地说来,教育学是最辨证、最灵活的一种科学,也是最复杂、最多样化的一种科学"。中学 化学教师只有认真学习和掌握各种教学方法和理论,才能在处理各种教学问题上游刃有余,从而有效提高教学质量。